¿Qué es el pH del ser humano?
Ph significa potencial de hidrógeno es decir
que es la cantidad de iones de hidrógeno libres en una sustancia
en el caso del ser humano seria en la sangre
esta medida se usa para determinar qué tan ácida o básica es una sustancia
el ph de la sangre humana debe ser ligeramente alcalino (7.35 – 7.45 )
por debajo o arriba de este rango es cuando hay complicaciones como
enfermedades.
algunos ejemplos.
Saliva - 6 a 7 de pH
Líquido Amniótico. 7 - 7.5 pH
Semen 7.2 - 8 pH
Lágrimas 7.5 pH
Orina 8.0 pH
Sangre 7.35 a 7.45 pH
Jugo Gástrico 1.5 pH
Saliva (pacientes con cáncer) 4,5 a 5,7
Sudor humano 5.5
Vomito 3,8 pH
ácido gástrico: 1.5
heces: 6 - 7
sudor: 6 - 8
cerumen: 6.1
semen: 7.5
ruido vaginal: 4.5 - 5
bilis: 7 - 7.
El pH de la piel es aproximadamente de 5.5 de media, variando ligeramente de
una zona a otra del cuerpo. Este valor es posible mantenerlo gracias al sudor y
sebo que se mezclan en la superficie corporal dando este pH, Por una parte
debemos recordar que para el buen estado de la piel y el cabello es muy
importante mantenerlo sin producir grandes variaciones. El uso indiscriminado
de productos que lo transforman en alcalino supone favorecer la penetración en
la piel de microorganismos y por lo tanto la aparición de enrojecimientos y
afecciones diversas.
El pH de la solución nutriente en contacto con las raíces puede afectar el
crecimiento vegetal de dos formas principalmente:
- el pH puede afectar la disponibilidad de los nutrientes: para que el aparato
radical pueda absorber los distintos nutrientes, éstos obviamente deben estar
disueltos. Valores extremos de pH pueden provocar la precipitación de ciertos
nutrientes con lo que permanecen en forma no disponible para las plantas.
- el pH puede afectar al proceso fisiológico de absorción de los nutrientes por
parte de las raíces: todas las especies vegetales presentan unos rasgos
característicos de pH en los que su absorción es idónea. Fuera de este rango la
absorción radicular se ve dificultada y si la desviación en los valores de pH
es extrema, puede verse deteriorado el sistema radical o presentarse
toxicidades debidas a la excesiva absorción de elementos Fito tóxicos
(aluminio).
La importancia del control del pH en el cuidado d una piscina
El pH óptimo para el agua de una piscina debe situarse en el rango 7.2-7.8, en
el que afortunadamente el cloro es donde presenta su mayor efectividad. Un agua
ácida (pH inferior a 7.0) puede producir corrosión en los accesorios de la
piscina, mientras que un pH demasiado alcalino (mayor de 7.8) favorecerá la
formación de incrustaciones calcáreas así como una pérdida de efectividad del
cloro.
En agricultura y suelos
El pH del suelo es generalmente considerado adecuado en agricultura si se
encuentra entre 6 y 7. En algunos suelos, incluso con un pH natural de 8,
pueden obtenerse buenos rendimientos agropecuarios. Sin embargo, a partir de
tal umbral las producciones de los cultivos pueden mermarse ostensiblemente. En
la mayoría de los casos, los pH altos son indicadores de la presencia de sales
solubles, por lo que se requeriría acudir al uso de cultivos adaptados a los
ambientes salinos. Del mismo modo, un pH muy ácido, resulta ser otro factor
limitante para el desarrollo de los cultivares, el cual puede corregirse
mediante el uso de enmiendas como la cal. Del mismo modo, a veces se aplican de
compuestos de azufre con vistas a elevar el pH de los suelos fuertemente
ácidos.
Importancia del pH en la sangre
la función más importante del pH en la sangre es que la actividad enzimática
solo se da adecuadamente en determinados pH, y la actividad enzimática
interviene en absolutamente todos los procesos metabólicos, la sangre actúa
como una solución tapón, es decir auto regula el impacto de sustancias que
pueden alterar el pH, aun así según las concentraciones de las sustancias que
entran al organismo, el pH puede verse alterado.
La importancia del pH en el agua
Cabe añadir que la diferencia entre un agua alcalina y un agua ácida se define
mediante un marcador convencionalmente utilizado: el pH (que significa
potencial de hidrogeniones ). ¿Y por qué es importante el grado de acidez o alcalinidad
del agua?, supongo que se preguntará el lector. Para explicarlo deberemos
sumergirnos en el acuoso interior del ser humano...
La química ácida y alcalina del cuerpo refiere al pH, o al hidrógeno potencial,
balance dentro del cuerpo. Si tenemos el equilibrio óptimo de ácido/alcalino,
tenemos balance de la química de la sangre, u homeostasis.
El pH de la solución nutriente en contacto con las raíces puede afectar el
crecimiento vegetal de dos formas principalmente:
- el pH puede afectar la disponibilidad de los nutrientes: para que el aparato
radical pueda absorber los distintos nutrientes, éstos obviamente deben estar
disueltos. Valores extremos de pH pueden provocar la precipitación de ciertos
nutrientes con lo que permanecen en forma no disponible para las plantas.
- el pH puede afectar al proceso fisiológico de absorción de los nutrientes por
parte de las raíces: todas las especies vegetales presentan unos rasgos
característicos de pH en los que su absorción es idónea. Fuera de este rango la
absorción radicular se ve dificultada y si la desviación en los valores de pH
es extrema, puede verse deteriorado el sistema radical o presentarse
toxicidades debidas a la excesiva absorción de elementos Fito tóxicos
(aluminio).
La importancia del control del pH en el cuidado d una piscina
El pH óptimo para el agua de una piscina debe situarse en el rango 7.2-7.8, en
el que afortunadamente el cloro es donde presenta su mayor efectividad. Un agua
ácida (pH inferior a 7.0) puede producir corrosión en los accesorios de la
piscina, mientras que un pH demasiado alcalino (mayor de 7.8) favorecerá la
formación de incrustaciones calcáreas así como una pérdida de efectividad del
cloro.
En agricultura y suelos
El pH del suelo es generalmente considerado adecuado en agricultura si se
encuentra entre 6 y 7. En algunos suelos, incluso con un pH natural de 8,
pueden obtenerse buenos rendimientos agropecuarios. Sin embargo, a partir de
tal umbral las producciones de los cultivos pueden mermarse ostensiblemente. En
la mayoría de los casos, los pH altos son indicadores de la presencia de sales
solubles, por lo que se requeriría acudir al uso de cultivos adaptados a los
ambientes salinos. Del mismo modo, un pH muy ácido, resulta ser otro factor
limitante para el desarrollo de los cultivares, el cual puede corregirse
mediante el uso de enmiendas como la cal. Del mismo modo, a veces se aplican de
compuestos de azufre con vistas a elevar el pH de los suelos fuertemente
ácidos.
Importancia del pH en la sangre
la función más importante del pH en la sangre es que la actividad enzimática
solo se da adecuadamente en determinados pH, y la actividad enzimática
interviene en absolutamente todos los procesos metabólicos, la sangre actúa
como una solución tapón, es decir auto regula el impacto de sustancias que
pueden alterar el pH, aun así según las concentraciones de las sustancias que
entran al organismo, el pH puede verse alterado.
La importancia del pH en el agua
Cabe añadir que la diferencia entre un agua alcalina y un agua ácida se define
mediante un marcador convencionalmente utilizado: el pH (que significa
potencial de hidrogeniones ). ¿Y por qué es importante el grado de acidez o alcalinidad
del agua?, supongo que se preguntará el lector. Para explicarlo deberemos
sumergirnos en el acuoso interior del ser humano...
La química ácida y alcalina del cuerpo refiere al pH, o al hidrógeno potencial,
balance dentro del cuerpo. Si tenemos el equilibrio óptimo de ácido/alcalino,
tenemos balance de la química de la sangre, u homeostasis.
- el pH puede afectar la disponibilidad de los nutrientes: para que el aparato
radical pueda absorber los distintos nutrientes, éstos obviamente deben estar
disueltos. Valores extremos de pH pueden provocar la precipitación de ciertos
nutrientes con lo que permanecen en forma no disponible para las plantas.
- el pH puede afectar al proceso fisiológico de absorción de los nutrientes por
parte de las raíces: todas las especies vegetales presentan unos rasgos
característicos de pH en los que su absorción es idónea. Fuera de este rango la
absorción radicular se ve dificultada y si la desviación en los valores de pH
es extrema, puede verse deteriorado el sistema radical o presentarse
toxicidades debidas a la excesiva absorción de elementos Fito tóxicos
(aluminio).
La importancia del control del pH en el cuidado d una piscina
El pH óptimo para el agua de una piscina debe situarse en el rango 7.2-7.8, en
el que afortunadamente el cloro es donde presenta su mayor efectividad. Un agua
ácida (pH inferior a 7.0) puede producir corrosión en los accesorios de la
piscina, mientras que un pH demasiado alcalino (mayor de 7.8) favorecerá la
formación de incrustaciones calcáreas así como una pérdida de efectividad del
cloro.
En agricultura y suelos
El pH del suelo es generalmente considerado adecuado en agricultura si se
encuentra entre 6 y 7. En algunos suelos, incluso con un pH natural de 8,
pueden obtenerse buenos rendimientos agropecuarios. Sin embargo, a partir de
tal umbral las producciones de los cultivos pueden mermarse ostensiblemente. En
la mayoría de los casos, los pH altos son indicadores de la presencia de sales
solubles, por lo que se requeriría acudir al uso de cultivos adaptados a los
ambientes salinos. Del mismo modo, un pH muy ácido, resulta ser otro factor
limitante para el desarrollo de los cultivares, el cual puede corregirse
mediante el uso de enmiendas como la cal. Del mismo modo, a veces se aplican de
compuestos de azufre con vistas a elevar el pH de los suelos fuertemente
ácidos.
Importancia del pH en la sangre
la función más importante del pH en la sangre es que la actividad enzimática
solo se da adecuadamente en determinados pH, y la actividad enzimática
interviene en absolutamente todos los procesos metabólicos, la sangre actúa
como una solución tapón, es decir auto regula el impacto de sustancias que
pueden alterar el pH, aun así según las concentraciones de las sustancias que
entran al organismo, el pH puede verse alterado.
La importancia del pH en el agua
Cabe añadir que la diferencia entre un agua alcalina y un agua ácida se define
mediante un marcador convencionalmente utilizado: el pH (que significa
potencial de hidrogeniones ). ¿Y por qué es importante el grado de acidez o alcalinidad
del agua?, supongo que se preguntará el lector. Para explicarlo deberemos
sumergirnos en el acuoso interior del ser humano...
La química ácida y alcalina del cuerpo refiere al pH, o al hidrógeno potencial,
balance dentro del cuerpo. Si tenemos el equilibrio óptimo de ácido/alcalino,
tenemos balance de la química de la sangre, u homeostasis.
- el pH puede afectar al proceso fisiológico de absorción de los nutrientes por
parte de las raíces: todas las especies vegetales presentan unos rasgos
característicos de pH en los que su absorción es idónea. Fuera de este rango la
absorción radicular se ve dificultada y si la desviación en los valores de pH
es extrema, puede verse deteriorado el sistema radical o presentarse
toxicidades debidas a la excesiva absorción de elementos Fito tóxicos
(aluminio).
La importancia del control del pH en el cuidado d una piscina
El pH óptimo para el agua de una piscina debe situarse en el rango 7.2-7.8, en
el que afortunadamente el cloro es donde presenta su mayor efectividad. Un agua
ácida (pH inferior a 7.0) puede producir corrosión en los accesorios de la
piscina, mientras que un pH demasiado alcalino (mayor de 7.8) favorecerá la
formación de incrustaciones calcáreas así como una pérdida de efectividad del
cloro.
En agricultura y suelos
El pH del suelo es generalmente considerado adecuado en agricultura si se
encuentra entre 6 y 7. En algunos suelos, incluso con un pH natural de 8,
pueden obtenerse buenos rendimientos agropecuarios. Sin embargo, a partir de
tal umbral las producciones de los cultivos pueden mermarse ostensiblemente. En
la mayoría de los casos, los pH altos son indicadores de la presencia de sales
solubles, por lo que se requeriría acudir al uso de cultivos adaptados a los
ambientes salinos. Del mismo modo, un pH muy ácido, resulta ser otro factor
limitante para el desarrollo de los cultivares, el cual puede corregirse
mediante el uso de enmiendas como la cal. Del mismo modo, a veces se aplican de
compuestos de azufre con vistas a elevar el pH de los suelos fuertemente
ácidos.
Importancia del pH en la sangre
la función más importante del pH en la sangre es que la actividad enzimática
solo se da adecuadamente en determinados pH, y la actividad enzimática
interviene en absolutamente todos los procesos metabólicos, la sangre actúa
como una solución tapón, es decir auto regula el impacto de sustancias que
pueden alterar el pH, aun así según las concentraciones de las sustancias que
entran al organismo, el pH puede verse alterado.
La importancia del pH en el agua
Cabe añadir que la diferencia entre un agua alcalina y un agua ácida se define
mediante un marcador convencionalmente utilizado: el pH (que significa
potencial de hidrogeniones ). ¿Y por qué es importante el grado de acidez o alcalinidad
del agua?, supongo que se preguntará el lector. Para explicarlo deberemos
sumergirnos en el acuoso interior del ser humano...
La química ácida y alcalina del cuerpo refiere al pH, o al hidrógeno potencial,
balance dentro del cuerpo. Si tenemos el equilibrio óptimo de ácido/alcalino,
tenemos balance de la química de la sangre, u homeostasis.
Conceptos Básic
- Cuando una solución es neutra, el número de protones iguala al número de iones hidroxilo.
- Cuando el número de iones hidroxilo es mayor, la solución es básica.
- Cuando el número de protones es mayor, la solución es ácida.
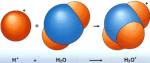
- Ácido: sustancia que en solución acuosa aumenta la concentración de iones de hidronio (H3O) o de iones hidrógeno (H).
- Base: sustancia que aumenta la concentración de oxidrilo (OH-) cuando están en solución.
- Ácido: sustancia capas de ceder un protón (p+) a otra sustancia.
- Base: como una sustancia capaz de aceptar un protón (p+) de un ácido.
- Par ácido-base conjugado: es aquel cuyos elementos están relacionados entre sí por la transferencia de un protón. Es decir la unión de un acido y una base produce siempre un ácido nuevo y una base nueva.
- Ácido: es cualquier especie química que puede aceptar un par de electrones (e-) provenientes de una base
- Base: es una sustancia que puede proporcionar un par electrónico.
Medida de las Fuerza de los ácidos y las bases
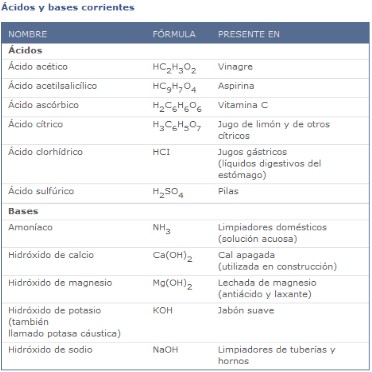
Ácidos y Bases más comunes
Cuando la temperatura es elevada aumenta la
energía cinética de las moléculas con lo que se desorganizan la envoltura
acuosa de las proteínas, y se desnaturalizan. Lo que significa que el interior hidrológico
interacciona con el medio acuosos y se produce la agregación y la precipitación
de la proteína desnaturalizada.
Una proteína puede adoptar diferentes
conformaciones dependiendo de la temperatura y de los hidrogeniones que están
en solución. Por eso, si cambiamos la concentración de hidrogeniones, es decir,
el pH de la solución, la proteína puede adoptar una conformación no funcional y
puede conducir a patologías y aun la
muerte. . De aquí que sea absolutamente necesario mantener el pH entra y extra celular de los seres vivos dentro de unos límites muy estrechos de pH.
El pH de la sangre, por ejemplo, es de 7.4.
si baja por debajo de 7.2 se tiene una condición llamada ACIDOSIS. Si sube por
encima de 7.6 tendremos ALACALOSIS.
el pH debe mantenerse constante en los seres
vivos. Cualquier variación del pH en el medio interno de los seres vivos puede
comportar graves problemas, pues las proteínas (presentes en todos los seres
vivos) pueden desnaturalizarse y, por tanto, dejar de hacer su función.
Los sistemas tampón son unos "mecanismos naturales" que tenemos los
seres vivos para mantener constante el pH.
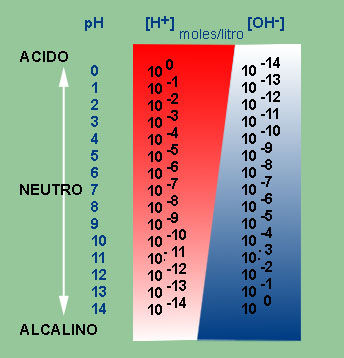
La mayoría de la gente sabe que el pH es un valor variable entre 0 a 14 que
indica la alcalinidad de una solución. Cuando nuestro organismo funciona mejor
es cuando el medio interior, tomado en su conjunto, posee un pH de 7,39 que es
ligeramente alcalino.
El pH es muy importante en sistemas biológicos como la nutrición humana ya que
el pH del jugo gástrico es de 1.0 -2.0 es decir muy ácido, lo cual tiene como
principal objetivo disminuir el pH del bolo alimenticio (actúa como solución
amortiguadora) y activar enzimas como la pepsina para que estas actúen sobre
los alimentos, en nutrición hay una dieta que es la alcalina y consiste en el
equilibrio del pH pues de lo contrario esto generaría gastritis y otras enfermedades.
La sangre tiene un pH neutro 7.0 y si este pH aumentara o disminuyera nuestro
sistema biológico estaría en riesgo mortal.
El pH de los diferentes líquidos y tejido orgánicos varía de una parte del
cuerpo a otra. Cuando se habla de un pH ideal para el organismo de 7,36 se
trata de todo el pH de la sangre y en menor medida, del pH del terreno, es
decir, el conjunto de líquidos orgánicos como la linfa, los plasmas
extracelulares (que rodean a las células) y los intracelulares (en el interior de
la célula). La sangre en efecto, es un líquido muy particular, cuyo pH
permanece estable para mantener la vida del organismo.
Cualquier modificación o cambio del pH sanguíneo, incluso la mínima, es
rápidamente corregida por el organismo y reconducida a la medida ideal de 77,39
caso contrario, aparecerán rápidamente los problemas físicos y las
modificaciones de conciencia.
Es aquí donde vemos la importancia del pH para el organismo, e incluso para
muchos otros campos como para la cultivación con la fertilización, para el
tratamiento del agua potable entre otros procesos útiles para el ser humano.
Además de que el pH varia de órdago a órgano
y de secreción a secreción.
En el cuidado de la piel:
IMPORTANCIA DEL
pH PARA LOS CULTIVOS.
Un ácido (del latín
acidas, que significa agrio) es considerado tradicionalmente como
cualquier compuesto químico que, cuando se disuelve en agua, produce una
disolución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7. Esto
se aproxima a la definición moderna de Johannes Nicolau Bromaste y Martin Larry,
quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base).
Algunos ejemplos comunes incluyen al ácido acético (en el vinagre),
y el ácido sulfúrico (usado en baterías de automóvil).
Propiedades
de los ácidos
1. Tienen sabor ácido como en el caso del
ácido cítrico en la naranja y el limón.
2. Cambian el color del papel tornasol azul a
rosado, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleína.
4. Producen quemaduras de la piel.
5. Son buenos conductores de electricidad en
disoluciones acuosas.
6. Reaccionan con metales activos (grupo I y
II A de la tabla periódica de los elementos) formando una sal e hidrógeno.
7. Reaccionan con bases para formar una sal
más agua.
8. Reaccionan con óxidos metálicos para
formar una sal más agua.
Una base es, en primera aproximación
(según Arrhenius),
cualquier sustancia que en disolución
acuosa
aporta iones
OH− al medio. Un ejemplo claro es el hidróxido potásico, de fórmula KOH:
KOH → OH− + K+ (en
disolución acuosa)
Los conceptos de base y ácido
son contrapuestos. Para medir la basicidad de un medio acuoso se utiliza el
concepto de pH, que se complementa con el de pH, de forma tal que
pH + pH = kW, (KW en CNPT es igual a 10−14). Por este motivo, está
generalizado el uso de pH tanto para ácidos como para bases.
Según Boye, bases son
aquellas sustancias que presentan las siguientes propiedades:
Poseen un sabor amargo característico.
No reaccionan con los metales.
Sus disoluciones conducen la corriente
eléctrica.
Azulean el papel de tornasol.
Reaccionan con los ácidos. (Neutralizándolos)
La mayoría son irritantes para la piel.
Tienen un tacto jabonoso.
Sus átomos se disocian aportando iones OH.⁻
El pH es
importante para los seres vivos
El pH se define como la concentración de
iones hidrogeniones. Nos da idea de la acidez (pH entre 0.1 -6.9),de la
basicidad(pH entre 7.1 - 14) o de la neutralidad (pH 7.0) de una sustancia o
medio.
Se pude determinar en forma cualitativa a
través de indicadores ácido-base, los cuales cambian de color de acuerdo con el
pH y en forma cuantitativa mediante el pH metro que da el valor exacto del pH.
A nivel biológico, el pH es de gran
importancia , ya que muchas de loa procesos o reacciones que ocurren en los
seres vivos están influenciados o regulados por el pH, así por ejemplo el
cultivo de microorganismos requiere de un control de pH muy riguroso puesto que
si este varia se mueren los microorganismos; la clase de cultivo que se siembra
depende en gran medida del pH del suelo en el que se vaya a cultivar; los
medicamentos y alimentos tienen un pH para su duración y acción; la acción de
las enzimas digestivas dependen de un pH ácido de 2 y se inactivan a un pH
mayor ; el grado de contaminación de las aguas se puede determinar por el valor
del pH; algunos anticonceptivos actúan alterando el pH de la vagina ocasionando
la destrucción de los espermatozoides.
Como se puede observar el pH es de gran
importancia para que los procesos en los seres vivos ocurran de manera óptima.
Los ácidos y bases se estudian de acuerdo a los enlaces (iónico o cvalente) que presentan en solución acuosa.
Sus disoluciones acuosas tienen sabor ácido y son conductoras. Corroen el metal desprendiendo H2 y enrojecen el Tornasol azul; decoloran la Fenolftaleína, y se vuelven menos ácidos cuando se mezclan con las bases. Se neutralizan con las bases dando lugar a sales.
Las Bases: Sus disoluciones acuosas tienen sabor cáustico y tacto jabonoso, además de ser conductoras y resbaladizas. El tornasol vira al azul y enrojecen la Fenolftaleína Se vuelven menos básicas cuando se mezclan con ácidos neutralizándose y dando lugar a la formación de sales. Aunque Boyle y otros trataron de explicar por qué los ácidos y las bases se comportan de tal manera, la primera definición razonable de los ácidos y las bases no sería propuesta hasta 200 años después. Los conocimientos modernos de los ácidos y las bases parten de 1834, cuando el físico inglés Michael Faraday descubrió que ácidos, bases y sales eran electrólitos por lo que, disueltos en agua se disocian en partículas con carga o iones que pueden conducir la corriente eléctrica.
Disociación es la separación de iones que existen en una sustancia que presenta enlace iónico
Antes de dar paso a estudiar las principales Teorías Ácido-Base, es necesario aclarar varios terminar que nos serán de gran utilidad a lo largo del estudio de las mismas, comenzando por definir precisamente lo que es una Teorías.
Teoría: Por el término Teoría entenderemos una serie de las leyes que sirven para relacionar determinado orden de fenómenos.
Disociación: Una disociación es la separación de los iones de una sustancia con enlace iónico cuando se encuentra en solución acuosa.PH: La palabra pH es la abreviatura de “pondus Hydrogenium”. Esto significa literalmente el peso del hidrógeno. El pH es un indicador del número de iones de hidrógeno (H+) en una sustancia o solución; dicho de otra manera, es un indicador de la acidez de una sustancia. El pH sirve como un indicador que compara algunos de los iones más solubles en agua.
El pH no tiene unidades; se expresa simplemente por un número. El resultado de una medición de pH viene determinado por una consideración entre el número de protones (iones H+) y el número de iones hidroxilo (OH-). Cuanto más se aleje el pH por encima o por debajo de 7, más básica o ácida será la solución.
El pH es un factor logarítmico; cuando una solución se vuelve diez veces más ácida, el pH disminuirá en una unidad. Cuando una solución se vuelve cien veces más ácida, el pH disminuirá en dos unidades. El término común para referirse al pH es la alcalinidad.
En la actualidad, se estudian estos compuestos según el tipo de enlace que presentan al estar en solución acuosa y, dependiendo del tipo de enlace, tendremos entonces una disociación o una ionización.
A Arrhenius sugirió que los ácidos son compuestos que contienen hidrógeno y pueden disolverse en el agua para soltar iones de hidrógeno a la solución.
La primera definición moderna de ácidos y bases se debe al químico sueco Svante Arrhenius (1859 – 1927), quien a finales de 1800, propuso que el agua puede disolver muchos compuestos separándolos en sus iones individuales
Y, como puedes observar, libera iones oxidrilos (OH-), de acuerdo con Arrhenius. No obstante la teoría de Arrhenius explica el comportamiento ácido-básico de una gran cantidad de sustancias, resulta muy limitada; por ejemplo, con esta teoría no se puede explicar el carácter básico del amoniaco (NH3).
El pH es de vital importacia para todos los seres vivos... por ejemplo en el humano un cambio ligero de pH sanguineo puede ocasionar hasta la muerte... El pH del estomago tiene que ser cercano a 1.0 para que se pueda llevar bien el proceso de digestion... en la orina si no se conserva el pH puede dar lugar a la aparicion de calculos renales... en la vagina de la mujer el pH acido mantiene a la flora microbiana controlada, si se altera el pH puede padecer de infecciones... el pH acido de la piel protege contra posibles infecciones... el pH de la boca tambien es importante para la salud bucal.